신선하게 조리된 육류 및 생선의 영양적 이점을 증가시키기 위한 단백질 가수분해 접근법의 개발.
Adrian Hewson-Hughes 박사의 과학적 지원 논문 | 영양, 식품 안전 및 혁신 고문, GA Pet Food Partners.


소개.
동물성 단백질 함량은 개와 고양이를 위한 프리미엄 품질 식품의 본질로 잘 확립되어 있으며 많은 애완 동물 소유자는 "양보다 품질"이라는 격언이 여기에 적용된다는 것을 인식합니다. 시장조사업체 민텔(Mintel)에 따르면 반려묘 주인의 59%와 반려견 주인의 57%가 반려동물 사료의 전체 고기 함량보다 고기의 질이 더 중요하다고 답했다. (민텔, 2017).
GA Pet Food Partners 오랫동안 이것을 인식했습니다. 도입 이후 Freshtrusion®, GA는 신선하게 준비된 육류 및 생선 단백질 공급원의 양이 증가하는 식단을 개발하고 제조하는 데 앞장서 왔습니다. 더 나은 맛과 소화율을 포함하여 건조되고 렌더링된 육류 및 생선 식사보다 신선한 육류 및 생선 소스를 사용하는 이점은 애완 동물과 소유자 모두에게 잘 알려져 있습니다.
파트너에게 더 나은 제품을 제공하기 위해 노력합니다.
애완 동물 사료 시장은 매우 역동적이며 제품에서 육류/어류/가금류의 정확한 높은 비율을 강조하는 것은 현명한 조치이지만, 이는 애완 동물 소유자가 이러한 제품에 대해 원하는 품질보다는 기본 기대치가 되고 있습니다. 여기 GA에서 우리는 파트너에게 더 나은 제품을 제공할 수 있는 방법을 지속적으로 찾고 있습니다. 그래서 불가능해 보이는 일을 시작했습니다. 즉, 신선한 고기와 생선 재료를 요리하여 애완 동물에게 더 좋게 만드는 방법을 고안하는 것입니다. .
이 아이디어는 단백질을 작은 펩타이드로 변환하여 이를 먹는 애완동물이 더 쉽게 흡수할 수 있도록 하여 신선한 육류 및 생선 성분 내 단백질의 영양가를 높이는 것입니다. 이 탐구에 도움이 되도록 노르웨이에 기반을 둔 응용 식품 연구의 선두 연구 기관인 Nofima의 전문가를 식별하여 선별된 육류 및 생선 원료의 효소 소화 조건을 최적화하고 분석하여 우리가 원하는 것을 달성할 수 있음을 입증했습니다. .



단백질 소화 – 일명 단백질 분해 또는 가수분해
단백질은 아미노산이라는 개별 '구성 요소'로 구성된 큰 분자입니다. 단백질을 함유한 식품을 섭취한 후, 위장관의 다른 부분에서 방출된 효소가 이를 아미노산과 작은 펩타이드로 분해함으로써 단백질 분해 과정이 시작됩니다. 이렇게 하면 이러한 빌딩 블록이 신체에 흡수되어 새로운 단백질(예: 근육, 피부, 모발, 항체, 효소, 호르몬 등)을 만들기 위해 결합될 수 있습니다.
또한 단백질 공급원은 제조 식품 및 영양 제품에 포함되기 위한 준비의 일부로 제어된 효소 단백질 분해 과정을 거칠 수 있습니다. 예를 들어, 단백질 가수분해물은 수십 년 동안 인간 영양, 특히 우유 단백질에 알레르기가 있는 영유아용 저자극성 유아 분유 생산에 사용되어 왔습니다.

효소적 또는 화학적 가수분해
단백질 가수분해(물을 첨가하여 아미노산을 함께 연결하는 펩티드 결합을 끊는 것)는 화학적으로 산 또는 염기(알칼리성)를 사용하거나 효소적으로(우리가 초점을 맞추고 있는 접근 방식)과 같은 다양한 방법으로 달성할 수 있습니다. 단백질의 산 및 알칼리 가수분해 방법은 저렴한 비용의 이점을 제공하지만 생성된 가수분해물의 영양 품질 측면에서 부정적인 결과가 있습니다. 산 가수분해는 필수 아미노산 트립토판의 완전한 파괴 뿐만 아니라 메티오닌, 시스틴 및 시스테인의 부분적 손실을 초래합니다. (파스풀레키 & 브라운, 2010). 유사하게, 알칼리 가수분해는 트립토판이 손상되지 않고 생존할 수 있지만 대부분의 아미노산의 완전한 파괴를 초래합니다. (다이, et al., 2014) (허우, et al., 2017).
산 및 알칼리 가수분해와 비교하여 단백질의 효소적 가수분해의 주요 이점은 다음과 같습니다.
- 온도 및 pH와 같은 가수분해 조건은 온화하며 알려진 아미노산 손실을 일으키지 않습니다.
- 프로테아제 효소(들)의 사용은 가수분해의 정도와 펩타이드의 크기를 제어하는 데 보다 구체적이고 정확합니다.
- 사용된 소량의 효소는 가수분해 반응을 중단하기 위해 쉽게 비활성화될 수 있습니다(예: 80 – 85ºC에서 3분 이상 가열). (허우, et al., 2017).


효소 가수분해 단백질의 영양학적 이점: 단백질 소화 및 흡수.
이전에 설명된 바와 같이 사용된 단백질 가수분해 방법 외에도 단백질 가수분해물의 영양가는 존재하는 유리 아미노산, 작은 펩티드(일반적으로 디 및 트리 펩티드) 및 큰 펩티드의 구성에 따라 달라집니다. 역사적으로 유리 아미노산만이 특정 아미노산 수송체에 의해 위장관에서 흡수되는 것으로 믿어졌습니다. 이것은 발생하지만, 이제 대부분의 아미노산이 광범위한 특이성 펩티드 수송체 PepT1에 의해 이중 및 삼중 펩티드로 흡수된다는 것이 인식됩니다. (페이, et al., 1994). PepT1은 잠재적으로 400가지 다른 식이 아미노산을 결합하여 생성된 8,000개의 디펩타이드와 20개의 트리펩타이드를 모두 수송할 수 있습니다. (다니엘, 2004). 따라서 높은 비율의 디 및 트리 펩티드를 함유하는 단백질 가수분해물의 섭취는 단백질 소화 및 흡수를 촉진하여 소화율 및 아미노산 생체이용률을 증가시킬 것으로 예상됩니다.
분명히, 최상의 효소 및 가수분해 조건을 설정하는 것은 원하는 최종 펩타이드 크기 프로필을 가진 단백질 가수분해물을 생성할 수 있도록 하는 데 중요합니다. 펩티드 크기 분포는 크기 배제 크로마토그래피라는 기술을 사용하여 결정할 수 있습니다. 크기 배제 크로마토그래피(SEC)는 용액에 용해된 분자 혼합물(예: 단백질 또는 펩티드)을 크기에 따라 분리하는 분석 화학 기술입니다(그림 1에 설명됨).
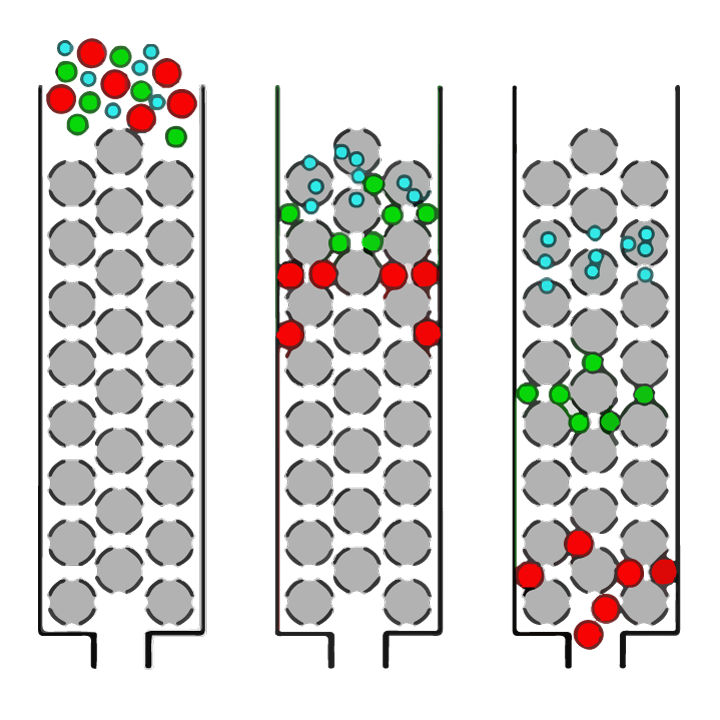
그림 1. 크기 배제 크로마토그래피(SEC)에 의한 용액 내 다양한 크기의 분자 분리에 대한 간단한 개요. 용액은 다공성 구형 비드(회색 구)의 수지로 채워진 컬럼에 적용됩니다. 큰 분자(빨간색 원)는 비드의 구멍(구멍)으로 들어갈 수 없으므로 상대적으로 빠르게 컬럼을 통과하여 먼저 감지됩니다. 샘플 내의 더 작은 분자는 크기에 따라 다양한 정도로 기공에 들어갈 수 있습니다. '중간 크기' 분자(녹색 원)는 일부 비드에 들어갈 수 있지만 다른 비드에는 들어갈 수 없으므로 컬럼을 통과하는 데 시간이 더 오래 걸리는 반면 가장 작은 분자(파란색 원)는 모든 구멍에 들어갈 수 있고 열을 통과하는 가장 긴 시간.
행동 양식
원자재 – 닭 도체, 오리 도체 및 연어 프레임의 신선한 샘플을 크기를 줄이고 두꺼운 페이스트로 균질화하고 냉동했습니다. 신선한 양고기 간을 통째로 냉동했습니다. 자료를 보냈습니다 노 피마, Ås, 노르웨이, 단백질 분해 및 분석용.
단백질 분해 – 각 원료(닭, 오리, 연어, 양)에 대하여 시료 500g을 유리 반응 용기에 증류수 990ml와 혼합하여 300rpm으로 교반하였다. 각 원료에 대해 48개의 다른 프로테아제 효소를 XNUMX개의 다른 농도와 XNUMX개의 시점에서 테스트하여 분석을 위한 XNUMX개의 가수분해물 샘플을 생성했습니다.
크기 배제 크로마토그래피 – 가수분해물의 수용성 단백질 분획의 분자량 분포는 20nm로 설정된 광다이오드 어레이 검출기(SPD M20A)가 있는 Shimadzu LC-214AT 고성능 액체 크로마토그래피(HPLC) 시스템을 사용하는 크기 배제 크로마토그래피에 의해 결정되었습니다.
콜라겐 펩타이드 함량 – Hydroxyproline은 변형된 아미노산으로 그 존재는 주로 콜라겐에 국한됩니다. 단백질 가수분해물의 하이드록시프롤린 함량은 존재하는 콜라겐/콜라겐 펩타이드의 양을 간접적으로 측정하는 데 사용할 수 있습니다. Nofima Biolab에서 각 원료의 전체 아미노산 분석(하이드록시프롤린 포함)을 수행했습니다. 또한 하이드록시프롤린 함량은 가수분해물의 수용성 분획에서 공인된 실험실(ALS, 노르웨이)에서 결정되었습니다.



결과
가수분해물의 펩티드 크기 분포 – 일반적으로 테스트된 각 효소에 대해 더 높은 농도의 효소와 더 긴 기간 동안 각 원료를 배양하면 가수분해물의 펩타이드 크기 프로파일에 '유익한' 이동이 발생했습니다(즉, 더 작은 펩타이드 비율의 증가 ). 이것은 '최적' 농도 및 지속 시간과 비교하여 '최적' 농도 및 지속 시간에서 '최적' 효소를 사용하여 각 원료에 대한 결과를 보여주는 그림 2에 강조 표시되어 있습니다. 최적화된 조건에서 우리는 100%의 펩타이드가 ≤3 kDa이고 75% 이상이 < 0.5 kDa임을 발견했습니다(그림 2).
여러 종(예: 쥐, 돼지, 개, 인간; (Zhangi & Matthews, 2010) 개요를 위해 일반적으로 다음과 같이 잘 받아들여집니다.
- 펩타이드의 흡수는 온전한 단백질에 비해 더 좋습니다.
- 펩타이드의 흡수는 유리 아미노산보다 우수합니다.
- 작은 펩타이드의 흡수는 큰 펩타이드보다 우수합니다.
생리학적으로 대부분의 아미노산은 2개 또는 3개의 아미노산이 결합된 작은 펩타이드로 흡수됩니다(각각 이 및 삼중 펩타이드). 따라서 높은 비율의 디 및 트리 펩티드를 함유하는 단백질 가수분해물의 섭취는 단백질 소화 및 흡수를 촉진하여 소화율 및 아미노산 생체이용률을 증가시킬 것으로 예상됩니다. 아미노산의 평균 분자량은 110달톤(Da)이므로 디- 및 트리-펩타이드의 분자량은 약 220-330Da(0.2-0.3kDa)입니다. 75kDa보다 작은 0.5% 이상의 펩타이드(즉, 최대 5개의 아미노산)로 단백질 가수분해물을 달성한 결과는 우리의 사료에 있는 단백질이 소화가 잘되고 그것을 먹는 애완 동물이 쉽게 흡수할 수 있음을 의미합니다. 겐트대학교 수의과대학과 공동으로 먹이 연구를 통해 이를 실증할 계획이다.
또한 100kDa 이하의 펩타이드를 3% 달성하면 단백질 공급원에 대한 알레르기 반응을 유발할 위험이 감소하므로 저자 극성으로 간주될 수 있습니다.
그림 2.
효소 농도 및 가수분해 기간 측면에서 '비최적화' 및 '최적화' 조건에서 동일한 효소와 함께 배양된 각 원료의 가수분해물의 수상에서 펩타이드의 크기 분포(kDa). 특히 '비최적화'에서 '최적화' 조건으로 이동하면서 1.0-3.0kDa 사이의 펩타이드 비율이 감소하고 펩타이드 <0.5kDa가 증가하는 방식에 주목하십시오.

콜라겐 펩타이드 함량
테스트한 각 원료에 대해 주어진 가수분해 기간과 효소 농도를 비교할 때 효소 A와 C는 일반적으로 효소 B보다 '더 나은' 성능(가수분해물의 수상에서 하이드록시프롤린의 더 많은 비율을 회수한다는 점에서)을 수행했습니다(예: 그림 3의 연어에 대한 결과).
'온전한' 콜라겐 단백질은 물에 용해되지 않기 때문에 수상에 하이드록시프롤린('콜라겐'의 마커)이 있다는 것은 콜라겐 단백질이 콜라겐 펩타이드(수용성)로 소화되었음을 나타냅니다. 우리의 결과는 효소적 단백질 분해를 사용하여 그 안에 존재하는 콜라겐 펩타이드를 통해 관절 건강, 피부 건강 및 장 건강을 지원하는 것과 같은 잠재적인 기능적 이점을 가져올 수 있는 원료를 만들 수 있음을 보여줍니다.

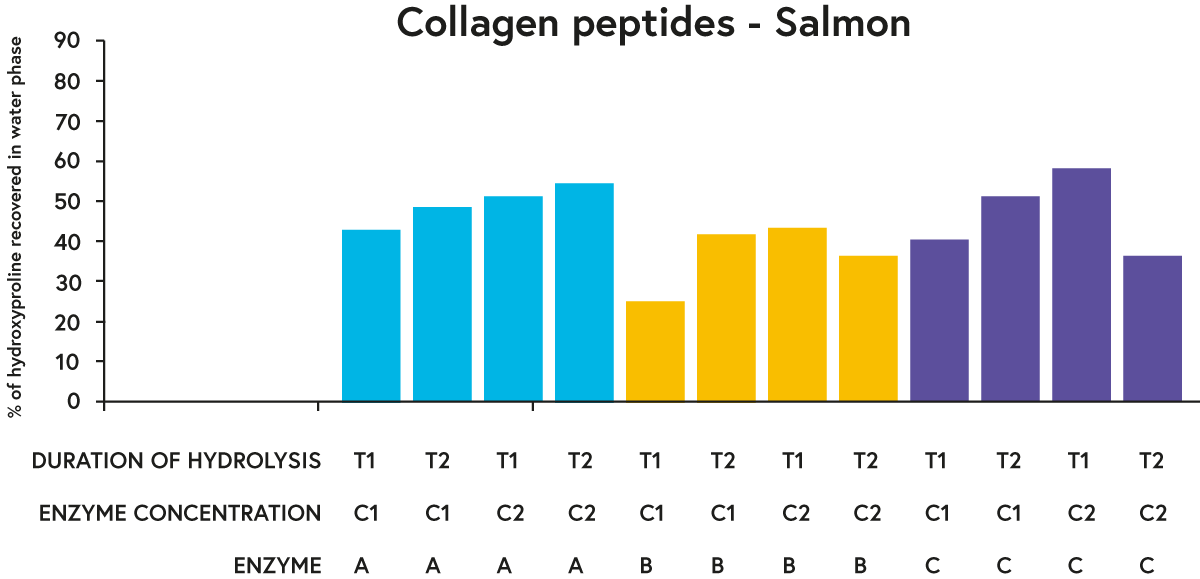
그림 3. 두 가지 다른 농도(C1 또는 C2)에서 원료(연어)와 배양된 세 가지 다른 효소(A, B 또는 C)로 가수분해된 연어의 수상에서 회수된 하이드록시프롤린(대부분 콜라겐에서만 발견되는 아미노산)의 비율 두 개의 다른 기간(T1 또는 T2).

결론
이러한 긍정적인 결과는 활동적인 애완 동물의 건강한 관절을 유지하고 나이든 애완 동물의 관절의 이동성 및 유연성을 향상시키는 것과 같은 기능적 이점을 제공할 수 있는 잠재력을 가진 콜라겐 펩타이드를 생성함으로써 특정 원료 내 콜라겐의 자연적 존재로부터 추가적인 가치를 얻을 수 있는 기회를 제시합니다. 예시.
이 연구를 기반으로 하는 '최적화된' 조건에서 생성된 작은 펩타이드(<75kDa)의 높은 비율(>0.5%)로, 우리의 첫 번째 부분은 HDP 목표가 달성됩니다. 다음으로 중요한 단계는 이 HDP로 만든 사료가 기존의 신선하게 준비된 제품보다 실제로 더 소화가 잘되고 생물학적으로 이용 가능하다는 것을 입증하는 것입니다. 겐트 대학교 수의사 학교. 이 공간을 주목하라!



참고자료
- Cave, N., 2006. 개와 고양이를 위한 가수분해 단백질 식단. Veterinary Clinics Small Animal Practice, 36권, 1251-1268페이지.
- Dai, Z., Wu, Z., Jia, S. & Wu, G., 2014. 형광 검출 기능이 있는 HPLC에 의한 프리컬럼 o-프탈디알데히드 유도체로서의 동물 조직 및 식품 단백질의 아미노산 조성 분석. J 크로마토그래피 B, 964권, 116-127페이지.
- Daniel, H., 2004. 장 펩티드 수송의 분자 및 통합 생리학. 생리학의 연례 검토, 66권, pp. 361-384.
- Fei, Y. et al., 1994. 포유류 양성자 결합 올리고펩티드 수송체의 발현 클로닝. Nature, Volume 7, pp. 563-566.
- Hanaoka, K. et al., 2019. 애완 동물 사료 제조 중 단백질 및 펩티드 분자량의 특성화. [온라인] 이용 가능: https://www.diana-petfood.com/emea-en/publications/
- Hou, Y. et al., 2017. 동물 영양의 단백질 가수분해물: 산업 생산, 생리 활성 펩티드 및 기능적 중요성. 동물 과학 및 생명 공학 저널, pp. 24-36.
- Knights, R., 1985. 단백질 가수분해물의 가공 및 평가. In: 특수 필요를 위한 영양. 뉴욕: Marcel Dekker, pp. 105-115.
- MINTEL, 2017. 애완 동물 사료의 단백질 측면에서 더 큰 투명성, sl: MINTEL 보고서.
- Pasupuleki, VK, Braun, S, 2010. 단백질 가수분해물의 최첨단 제조. In: 생명공학의 단백질 가수분해물. 뉴욕: Springer, pp. 11-32.
- Zhangi, B. & Matthews, J., 2010. 단백질 가수분해물 흡수의 생리학적 중요성 및 메커니즘. In: 생명공학의 단백질 가수분해물. 뉴욕: Springer, pp. 135-177.
