A fehérjehidrolízis megközelítésének fejlesztése a frissen készített hús és hal táplálkozási előnyeinek növelése érdekében.
Dr. Adrian Hewson-Hughes tudományos segédanyaga | Táplálkozási, élelmiszerbiztonsági és innovációs tanácsadó, GA Pet Food Partners.


Bevezetés.
Az állati fehérjetartalom jól bevált, mint a prémium minőségű kutyák és macskák számára készült élelmiszerek esszenciája, és sok állattartó elismeri, hogy itt érvényes a „minőség a mennyiség felett” mondás. A Mintel piackutató cég szerint a macskatulajdonosok 59%-a és a kutyatulajdonosok 57%-a szerint a hús minősége fontosabb, mint az állateledel teljes hústartalma. (MINTEL, 2017).
GA Pet Food Partners ezt már régóta felismerte. Bevezetése óta Freshtrusion®, GA élen járt az egyre nagyobb mennyiségű frissen készített hús- és halfehérjeforrást tartalmazó étrendek kifejlesztésében és gyártásában. A friss hús- és halforrások szárított, kiolvasztott hús- és hallisztekkel szembeni használatának előnyeit, beleértve a jobb ízt és a jobb emészthetőséget, mind a háziállatok, mind a gazdáik nagyra értékelik.
Arra törekszünk, hogy még jobb termékeket kínáljunk Partnereinknek.
Az állateledel piaca nagyon dinamikus, és bár a hús/hal/baromfi pontosan magas arányának kiemelése a termékekben bölcs lépés, ez már inkább alapelvárás, mintsem a kívánt minőség ezeknél a termékeknél az állattartók részéről. Itt, a GA-nál folyamatosan arra törekszünk, hogy még jobb termékeket kínálhassunk partnereinknek, ezért a lehetetlennek tűnő dolgok megtételére törekszünk – találjunk ki egy módot a friss hús- és halalapanyagaink elkészítésére, hogy azok még jobbak legyenek a háziállatok számára. .
Az ötlet az, hogy növeljük a fehérje tápértékét a friss hús- és halösszetevőinkben azáltal, hogy a fehérjét kis peptidekké alakítjuk, amelyeket az azt fogyasztó háziállatok könnyebben felszívnak (ezt „HDP”-nek nevezzük – jól emészthető fehérje). Hogy segítsünk ebben a küldetésben, a Nofima, egy vezető norvégiai alkalmazott élelmiszerkutatási kutatóintézet szakértőit azonosítottuk, hogy optimalizálják a kiválasztott hús- és halalapanyagok enzimatikus emésztésének feltételeit, és elemezzék azokat, hogy bebizonyítsák, el tudjuk érni, amit akarunk. .



Fehérje emésztés – más néven Proteolízis vagy hidrolízis
A fehérjék olyan nagy molekulák, amelyek egyedi „építőkövekből”, úgynevezett aminosavakból állnak. A fehérjetartalmú ételek elfogyasztása után megindul a proteolízis folyamata, amikor a gyomor-bél traktus különböző részein felszabaduló enzimek azt aminosavakra és kis peptidekre bontják. Ez lehetővé teszi, hogy ezek az építőelemek felszívódjanak a szervezetbe, ahol új fehérjék (például izom, bőr, haj, antitestek, enzimek, hormonok stb.) felépülése érdekében újra kombinálhatók.
Lehetőség van arra is, hogy a fehérjeforrások ellenőrzött enzimatikus proteolízis folyamaton menjenek keresztül a feldolgozott élelmiszerekbe és táplálkozási termékekbe való felkészítésük részeként. Például a fehérje-hidrolizátumokat évtizedek óta használják az emberi táplálkozásban, különösen a tehéntejfehérjére allergiás csecsemők/gyermekek hipoallergén anyatej-tápszereinek előállításában.

Enzimatikus vagy kémiai hidrolízis
A fehérjehidrolízis – az aminosavakat összekötő peptidkötések felszakítása víz hozzáadásával – különböző módszerekkel valósítható meg: savak vagy bázisok kémiai úton (lúgos) vagy enzimatikusan (a megközelítésre fókuszálunk). Míg a fehérjék savas és lúgos hidrolízisének előnye az alacsony költség, ennek negatív következményei vannak az előállított hidrolizátumok táplálkozási minőségét illetően. A savas hidrolízis a triptofán esszenciális aminosav teljes pusztulását, valamint a metionin, cisztin és cisztein részleges elvesztését eredményezi. (Pasupuleki és Braun, 2010). Hasonlóképpen, a lúgos hidrolízis a legtöbb aminosav teljes elpusztulását eredményezi, bár a triptofán érintetlenül is túlélheti (Dai, és mtsai., 2014), (Szia, és mtsai., 2017).
A savas és lúgos hidrolízishez képest a fehérjék enzimatikus hidrolízisének fő előnyei a következők:
- A hidrolízis körülményei, mint például a hőmérséklet és a pH enyhék, és nem okoznak ismert aminosavveszteséget.
- A proteáz enzim(ek) használata specifikusabb és pontosabb a hidrolízis mértékének és a peptidek méretének szabályozásában.
- A felhasznált kis mennyiségű enzim könnyen deaktiválható (pl. 80-85°C-ra melegítve legalább 3 percig), hogy megállítsuk a hidrolízis reakciót. (Szia, és mtsai., 2017).


Az enzimatikusan hidrolizált fehérje táplálkozási előnyei: fehérje emészthetőség és felszívódás.
A fehérjehidrolizátumok tápértéke az alkalmazott fehérjehidrolízis módszeren túlmenően a jelenlévő szabad aminosavak, kis peptidek (jellemzően di- és tripeptidek) és nagy peptidek összetételétől is függ. Történelmileg azt hitték, hogy csak a szabad aminosavakat szívják fel a gyomor-bél traktusból specifikus aminosav-transzporterek. Ez megtörténik, de ma már felismerték, hogy az aminosavak többségét di- és tripeptidként szívja fel a széles specifitású PepT1 peptid transzporter. (Fei, és mtsai., 1994). A PepT1 potenciálisan képes szállítani mind a 400 dipeptidet és 8,000 tripeptidet, amelyek a 20 különböző étrendi aminosav kombinációjából származnak (Dániel, 2004). Ezért várható, hogy egy nagy arányban di- és tripeptidet tartalmazó fehérje-hidrolizátum fogyasztása megkönnyíti a fehérje emésztését és felszívódását, ami megnövekedett emészthetőséget és aminosavak biológiai hozzáférhetőségét eredményezi.
Nyilvánvaló, hogy a legjobb enzim- és hidrolízis-körülmények megteremtése kritikus fontosságú ahhoz, hogy a kívánt végső peptidméret-profillal rendelkező fehérjehidrolizátumokat lehessen előállítani. A peptid méreteloszlása a méretkizárásos kromatográfiának nevezett technikával határozható meg. A méretkizárásos kromatográfia (SEC) egy analitikai kémiai technika, amelyben az oldatban oldott molekulák (például fehérjék vagy peptidek) keverékeit méretük szerint választják el egymástól (az 1. ábrán látható módon).
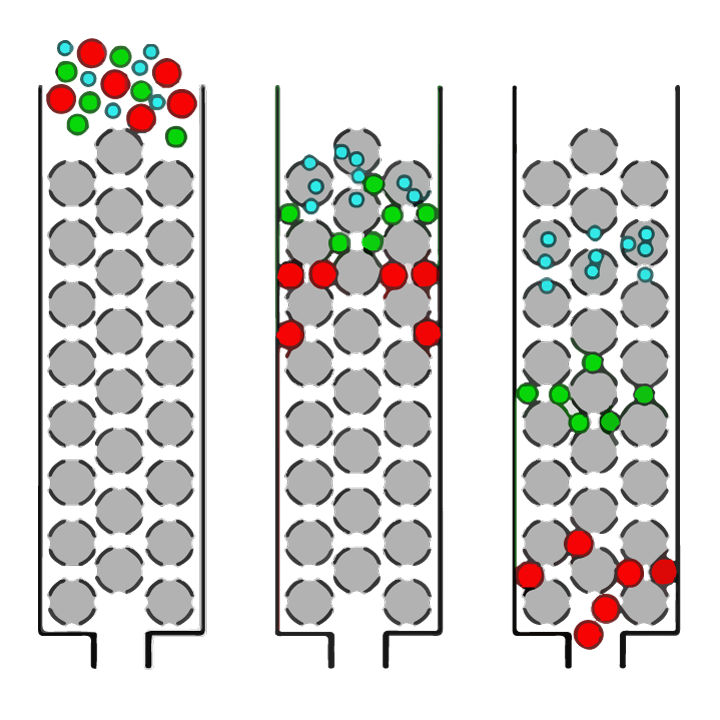
1 ÁBRA. Egyszerű áttekintés a különböző méretű molekulák oldatban történő szétválasztásáról méretkizárásos kromatográfiával (SEC). Az oldatot egy oszlopra visszük, amely porózus gömb alakú gyöngyökből (szürke gömbökből) álló gyantával van megtöltve. A nagy molekulák (piros körök) nem tudnak bejutni a gyöngyök pórusaiba (lyukakba), ezért viszonylag gyorsan áthaladnak az oszlopon, és először észlelik őket. A mintán belüli kisebb molekulák méretüktől függően eltérő mértékben juthatnak be a pórusokba. A „közepes méretű” molekulák (zöld körök) bejuthatnak egyes gyöngyökbe, másokba nem, így hosszabb ideig tart áthaladni az oszlopon, míg a legkisebb molekulák (kék körök) bejuthatnak az összes pórusba, a leghosszabb áthaladni az oszlopon.
Mód
nyersanyagok – Friss csirke-, kacsa- és lazactest-mintákat méretre csökkentett, sűrű péppé homogenizáltuk és lefagyasztottuk. A friss báránymájat egészben lefagyasztották. Az anyagokat a címre küldték Nofima, Ås, Norvégia, proteolízishez és elemzéshez.
Proteolízis – Minden alapanyaghoz (csirke, kacsa, lazac és bárány) egy 500 g-os mintát 990 ml desztillált vízzel kevertünk össze egy üveg reakcióedényben, és 300 fordulat/perc sebességgel kevertük. Minden nyersanyag esetében három különböző proteáz enzimet teszteltünk két különböző koncentrációban és két időpontban, így 48 hidrolizátummintát kaptunk elemzésre.
Méretkizárásos kromatográfia – A hidrolizátumok vízoldható fehérjefrakciójának molekulatömeg-eloszlását méretkizárásos kromatográfiával határoztuk meg Shimadzu LC-20AT nagy teljesítményű folyadékkromatográfiás (HPLC) rendszerrel, 20 nm-re beállított fotodiódasoros detektorral (SPD M214A).
Kollagén peptid tartalom – A hidroxiprolin egy módosított aminosav, amelynek jelenléte elsősorban a kollagénre korlátozódik. A fehérje-hidrolizátumok hidroxiprolintartalma a jelenlévő kollagén/kollagén peptidek mennyiségének közvetett mértékeként használható. Mindegyik nyersanyag teljes aminosav-analízisét (beleértve a hidroxiprolint is) a Nofima Biolab végezte el; emellett a hidroxiprolin-tartalmat egy akkreditált laboratóriumban (ALS, Norvégia) határozták meg a hidrolizátumok vízoldható frakciójában.



Eredmények
A hidrolizátumok peptidméret-eloszlása – Általánosságban elmondható, hogy minden egyes vizsgált enzim esetében az egyes nyersanyagok magasabb enzimkoncentrációval és hosszabb ideig tartó inkubálása „jótékony” eltolódást eredményezett a hidrolizátumok peptidméret-profiljában (azaz a kisebb peptidek arányának növekedését). ). Ezt emeli ki a 2. ábra, amely a „legjobb” enzimet használó nyersanyagok eredményeit mutatja „nem optimális” koncentrációban és időtartamban, összehasonlítva az „optimális” koncentrációval és időtartammal. Optimalizált körülmények között azt találtuk, hogy a peptidek 100%-a ≤3 kDa, és több mint 75%-a <0.5 kDa (2. ábra).
Számos fajon (pl. patkány, sertés, kutya, ember) végzett több vizsgálat kollektív bizonyítéka alapján; ld (Zhangi és Matthews, 2010) áttekintésként általánosan elfogadott, hogy:
- A peptidek felszívódása jobb az ép fehérjéhez képest.
- A peptidek felszívódása jobb, mint a szabad aminosavaké.
- A kis peptidek felszívódása jobb, mint a nagy peptideké.
Fiziológiailag az aminosavak többsége kis peptidekként szívódik fel, amelyek 2 vagy 3 aminosavból állnak, amelyek egymáshoz kapcsolódnak (di- és tripeptidek). Ezért várható, hogy egy nagy arányban di- és tripeptidet tartalmazó fehérje-hidrolizátum fogyasztása megkönnyíti a fehérje emésztését és felszívódását, ami megnövekedett emészthetőséget és aminosavak biológiai hozzáférhetőségét eredményezi. Egy aminosav átlagos molekulatömege 110 Dalton (Da), így a di- és tripeptidek molekulatömege körülbelül 220-330 Da (0.2-0.3 kDa). A 75 kDa-nál kisebb peptidek több mint 0.5%-át (azaz legfeljebb ~ 5 aminosavat tartalmazó) tartalmazó fehérje-hidrolizátumokat elért eredményeink azt jelentik, hogy az aprócskaink fehérje jól emészthető és könnyen felszívódik az azt evő háziállatok számára. A tervek szerint ezt a Genti Egyetem Állatorvostudományi Karával együttműködve egy takarmányozási tanulmányon keresztül demonstrálják.
Ezenkívül a 100 kDa vagy annál kisebb peptidek 3%-ának elérése csökkenti a fehérjeforrásokkal szembeni allergiás reakció kiváltásának kockázatát, ezért hipoallergénnek tekinthető.
Ábra 2.
A peptidek méreteloszlása (kDa) az egyes nyersanyagok hidrolizátumainak vizes fázisában, „nem optimalizált” és „optimalizált” körülmények között, az enzimkoncentráció és a hidrolízis időtartama tekintetében. Különösképpen figyelje meg, hogy az 1.0-3.0 kDa közötti peptidek százalékos aránya hogyan csökken, és a 0.5 kDa alatti peptideké növekszik, a „nem optimalizált” állapotról az „optimalizált” állapot felé haladva.

Kollagén peptid tartalom
Minden vizsgált nyersanyag esetében az A és C enzim általában „jobban” teljesített (a hidroxiprolin nagyobb százalékának visszanyerése szempontjából a hidrolizátumok vizes fázisában), mint a B enzim, ha összehasonlítjuk a hidrolízis adott időtartamát és az enzimkoncentrációt (pl. eredmények a lazacra a 3. ábrán).
Mivel az "ép" kollagén fehérje nem oldódik vízben, a hidroxiprolin (a "kollagén" markerünk) jelenléte a vízfázisban azt jelzi, hogy a kollagén fehérje kollagén peptidekké emésztődött (amelyek vízben oldódnak). Eredményeink azt mutatják, hogy képesek vagyunk enzimatikus proteolízist felhasználni olyan nyersanyagok létrehozására, amelyek potenciális funkcionális előnyökkel járhatnak, például támogatják az ízületek egészségét, a bőr egészségét és a bélrendszer egészségét a bennük lévő kollagén peptideken keresztül.

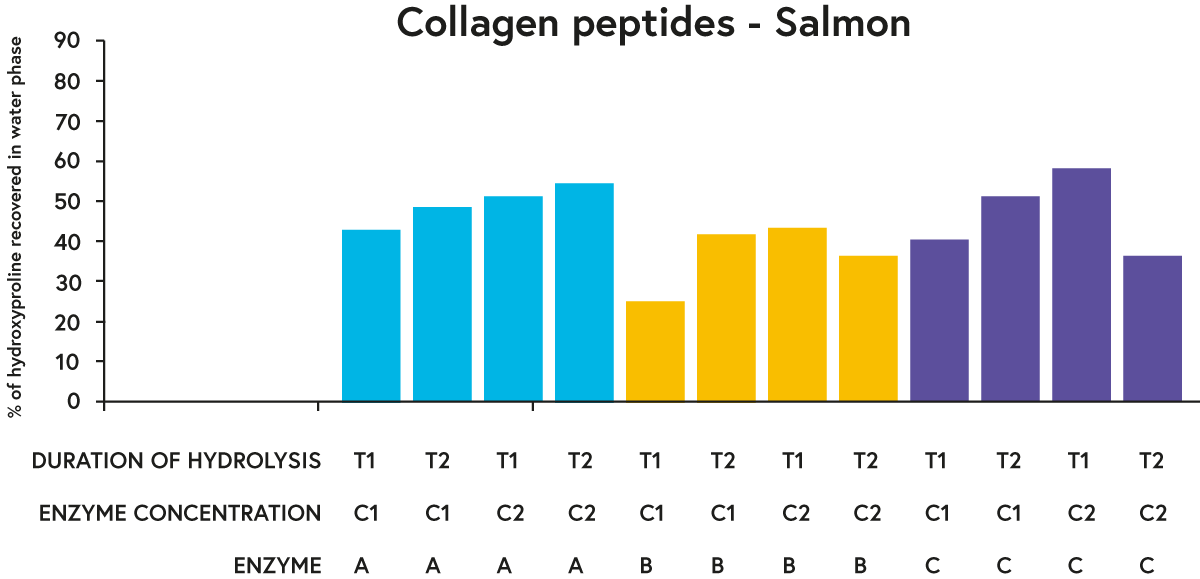
ábra 3. A hidrolizált lazac vízfázisában három különböző enzimmel (A, B vagy C) nyert hidroxiprolin (egy szinte kizárólag kollagénben található aminosav) százalékos aránya a nyersanyaggal (lazaccal) két különböző koncentrációban (C1 vagy C2) inkubálva. két különböző időszak (T1 vagy T2).

Következtetés
Ezek a pozitív eredmények lehetőséget adnak arra, hogy extra értéket nyerjünk a kollagén természetes jelenlétéből bizonyos nyersanyagokban azáltal, hogy olyan kollagénpeptideket hoznak létre, amelyek funkcionális előnyökkel járhatnak, mint például az egészséges ízületek megőrzése aktív háziállatoknál, valamint az ízületek mobilitásának és rugalmasságának javítása idősebb állatoknál. példa.
A kutatás alapján a kis peptidek (<75 kDa) nagy százaléka (>0.5%) „optimalizált” körülmények között termelődött. HDP cél megvalósul. A következő fontos lépés annak bizonyítása, hogy az ezzel a HDP-vel készült apríték valóban jobban emészthető és biológiailag hozzáférhetőbb, mint a meglévő, frissen elkészített termékeink – ennek elvégzésével foglalkozunk egy takarmányozási vizsgálatban Gent Egyetem Állatorvos iskola. Figyeld ezt a helyet!



Referenciák
- Cave, N., 2006. Hidrolizált fehérje diéták kutyáknak és macskáknak. Veterinary Clinics Small Animal Practice, 36. évfolyam, 1251-1268.
- Dai, Z., Wu, Z., Jia, S. & Wu, G., 2014. Az aminosav-összetétel elemzése állati szövetek és élelmiszerek fehérjéiben, mint oszlop előtti o-ftáldialdehid származékok HPLC-vel, fluoreszcencia detektálással. J Chromatography B, 964. kötet, 116-127.
- Daniel, H., 2004. Az intestinális peptidtranszport molekuláris és integratív fiziológiája. Annual Review of Physiology, 66. kötet, 361-384.
- Fei, Y. és munkatársai, 1994. Emlősök protonhoz kapcsolt oligopeptid transzporter expressziós klónozása. Nature, 7. kötet, 563-566.
- Hanaoka, K. et al., 2019. Fehérjék és peptidek molekulatömegének jellemzése az állateledel ízesítőinek gyártása során. [Online] Elérhető: https://www.diana-petfood.com/emea-en/publications/
- Hou, Y. et al., 2017. Protein hidroizátok az állati takarmányozásban: Ipari termelés, bioaktív peptidek és funkcionális jelentősége. Journal of Animal Science and Biotechnology, 24-36.
- Knights, R., 1985. Fehérje-hidrolizátumok feldolgozása és értékelése. In: Táplálkozás speciális igényeknek. New York: Marcel Dekker, 105-115.
- MINTEL, 2017. Nagyobb átláthatóság a fehérje tekintetében az állateledelben, sl: MINTEL REPORTS.
- Pasupuleki, VK, Braun, S, 2010. A fehérjehidrolizátumok legkorszerűbb gyártása. In: Protein Hydrolysates in Biotechnology. New York: Springer, 11-32.
- Zhangi, B. & Matthews, J., 2010. A fehérjehidrolizátum felszívódásának élettani jelentősége és mechanizmusai. In: Protein Hydrolysates in Biotechnology. New York: Springer, 135-177.
