Розробка підходу до гідролізу білків для підвищення поживних властивостей свіжоприготованого м’яса та риби.
Наукова допоміжна стаття д-ра Адріана Гьюсона-Хьюза | Радник з питань харчування, харчової безпеки та інновацій, GA Pet Food Partners.


Введення.
Вміст тваринного білка є основою високоякісних кормів для собак і котів, і багато власників домашніх тварин визнають, що тут діє прислів’я «якість над кількістю». За даними дослідницької компанії Mintel, 59% власників кішок і 57% власників собак вважають, що якість м’яса є важливішою за загальний вміст м’яса в кормі для домашніх тварин. (MINTEL, 2017).
GA Pet Food Partners давно це визнала. З моменту введення в Freshtrusion®, GA є лідером у розробці та виробництві дієт, що містять все більшу кількість свіжоприготованого м’яса та джерел білка риби. Переваги використання свіжого м’яса та риби над сушеними, топленими м’ясними та рибними стравами, включаючи кращий смак і покращену засвоюваність, добре оцінюють як домашні тварини, так і їхні власники.
Прагнемо пропонувати нашим Партнерам ще кращі продукти.
Ринок кормів для домашніх тварин є дуже динамічним, і хоча висвітлення точної високої частки м’яса/риби/птиці в продуктах є мудрим кроком, це стає базовим очікуванням, а не бажаною якістю цих продуктів від власників домашніх тварин. Тут, у GA, ми постійно прагнемо знайти способи пропонувати партнерам ще кращі продукти, і саме тому ми вирішили зробити, здавалося б, неможливе – придумати спосіб готувати наші свіжі м’ясні та рибні інгредієнти, щоб зробити їх ще кращими для домашніх тварин .
Ідея полягає в тому, щоб підвищити поживну цінність білка в наших інгредієнтах зі свіжого м’яса та риби шляхом перетворення білка на маленькі пептиди, які легше засвоюються домашніми тваринами, які їх їдять (ми називаємо це «HDP» — високозасвоюваний білок). Щоб допомогти нам у цьому пошуку, ми вибрали експертів із Nofima, провідного науково-дослідного інституту прикладних харчових досліджень у Норвегії, щоб оптимізувати умови для ферментативного перетравлення вибраної м’ясної та рибної сировини та проаналізувати їх, щоб продемонструвати, що ми можемо досягти бажаного. .



Перетравлення білків - також також відомо як протеоліз або гідроліз
Білки — це великі молекули, що складаються з окремих «будівельних блоків», які називаються амінокислотами. Після вживання їжі, що містить білок, починається процес протеолізу, коли ферменти, що виділяються в різних частинах шлунково-кишкового тракту, розщеплюють його на амінокислоти та невеликі пептиди. Це дозволяє цим будівельним блокам поглинатися в організмі, де їх можна рекомбінувати для створення нових білків (таких як м’язи, шкіра, волосся, антитіла, ферменти, гормони тощо).
Джерела білка також можуть піддаватися контрольованому процесу ферментативного протеолізу як частини їх підготовки до включення у промислові харчові продукти та харчові продукти. Наприклад, протеїнові гідролізати десятиліттями використовуються в харчуванні людини, особливо у виробництві гіпоалергенних дитячих молочних сумішей для немовлят/дітей з алергією на білок коров’ячого молока.

Ферментативний або хімічний гідроліз
Гідроліз білка – розрив пептидних зв’язків, які з’єднують амінокислоти за допомогою додавання води – можна досягти різними методами: хімічним шляхом за допомогою кислот або лугів (лужні) або ферментативним (підхід, на якому ми зосереджуємось). У той час як методи кислотного та лужного гідролізу білків пропонують перевагу низької вартості, є негативні наслідки з точки зору поживної якості одержаних гідролізатів. Кислотний гідроліз призводить до повного руйнування незамінної амінокислоти триптофану, а також до часткової втрати метіоніну, цистину та цистеїну. (Пасупулекі та Браун, 2010). Подібним чином лужний гідроліз призводить до повного руйнування більшості амінокислот, хоча триптофан може виживати незмінним (Дай, та інші, 2014) (Хоу, та інші, 2017).
Порівняно з кислотним і лужним гідролізом основні переваги ферментативного гідролізу білків:
- Умови гідролізу, такі як температура та pH, є м’якими та не призводять до відомої втрати амінокислот.
- Використання ферменту(ів) протеази є більш специфічним і точним у контролі ступеня гідролізу та розміру пептидів.
- Невеликі кількості використаного ферменту можна легко дезактивувати (наприклад, нагріванням до 80–85ºC протягом принаймні 3 хвилин), щоб зупинити реакцію гідролізу. (Хоу, та інші, 2017).


Поживні переваги ферментативно гідролізованого білка: перетравність і засвоєння білка.
Окрім використовуваного методу гідролізу білка, як зазначено раніше, поживна цінність білкових гідролізатів залежить від складу присутніх вільних амінокислот, малих пептидів (зазвичай ди- та трипептидів) і великих пептидів. Історично вважалося, що тільки вільні амінокислоти всмоктуються зі шлунково-кишкового тракту за допомогою специфічних транспортерів амінокислот. Це дійсно відбувається, але тепер визнано, що більшість амінокислот поглинається у вигляді ди- та трипептидів широкоспецифічним пептидним транспортером PepT1 (Фей, та інші, 1994). PepT1 потенційно може транспортувати всі 400 дипептидів і 8,000 трипептидів, які є результатом поєднання 20 різних харчових амінокислот. (Даніель, 2004). Тому можна очікувати, що прийом білкового гідролізату, що містить високі пропорції ди- та трипептидів, сприятиме перетравленню та засвоєнню білка, що призведе до підвищення засвоюваності та біодоступності амінокислот.
Очевидно, що встановлення найкращих умов ферменту та гідролізу має вирішальне значення для створення білкових гідролізатів із бажаними кінцевими профілями розміру пептиду. Розподіл пептидів за розміром можна визначити за допомогою техніки, яка називається ексклюзійною хроматографією. Ексклюзійна хроматографія (SEC) — це техніка аналітичної хімії, за якої суміші молекул (наприклад, білків або пептидів), розчинених у розчині, поділяють за розміром (як показано на малюнку 1).
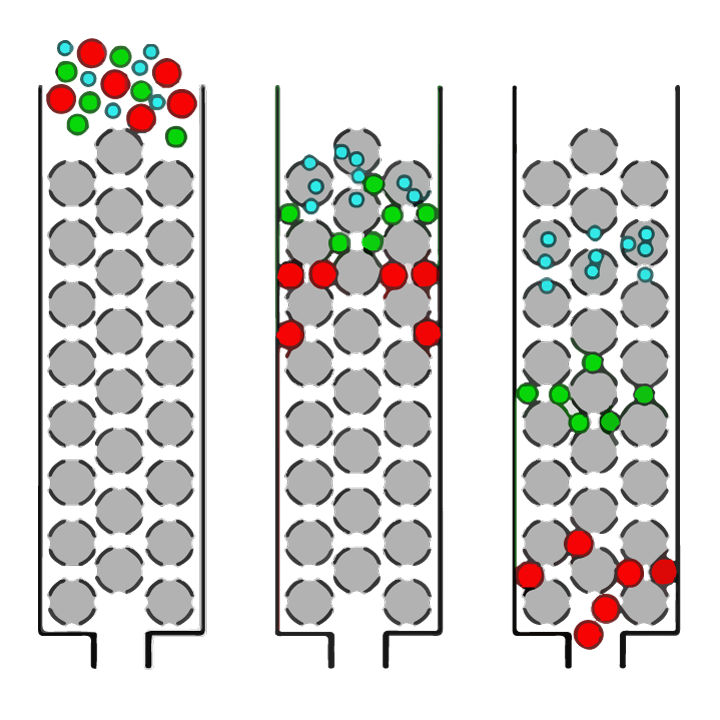
ФІГУРА 1. Простий огляд поділу молекул різного розміру в розчині за допомогою ексклюзійної хроматографії (SEC). Розчин наносять на колонку, наповнену смолою з пористих сферичних кульок (сірих сфер). Великі молекули (червоні кружечки) не зможуть увійти в пори (отвори) кульок і, отже, пройдуть колоною відносно швидко і будуть виявлені першими. Менші молекули у зразку можуть проникати в пори різною мірою залежно від їх розміру. Молекули «середнього розміру» (зелені кружечки) зможуть увійти в одні кульки, але не в інші, тому їм знадобиться більше часу, щоб пройти через колонку, тоді як найменші молекули (сині кружечки) зможуть увійти в усі пори та займуть найдовше пройти через колону.
Методи
Сировина – Свіжі зразки курячої тушки, тушки качки та каркаси лосося були зменшені, гомогенізовані в густу пасту та заморожені. Свіжу баранячу печінку заморожували цілком. Матеріали надіслано на адресу Нофіма, Ås, Норвегія, для протеолізу та аналізу.
Протеоліз – Для кожної сировини (курка, качка, лосось і баранина) 500 г зразка змішували з 990 мл дистильованої води в скляній реакційній посудині та перемішували при 300 об/хв. Для кожної сировини було протестовано три різні ферменти протеази у двох різних концентраціях і двох часових точках, що призвело до отримання 48 зразків гідролізату для аналізу.
Ексклюзійна хроматографія – Розподіл молекулярної маси водорозчинної білкової фракції гідролізатів визначали за допомогою ексклюзійної хроматографії з використанням системи високоефективної рідинної хроматографії (HPLC) Shimadzu LC-20AT з фотодіодним детектором (SPD M20A), встановленим на 214 нм.
Вміст колагенового пептиду – Гідроксипролін – це модифікована амінокислота, присутність якої в основному обмежується колагеном. Вміст гідроксипроліну в білкових гідролізатах можна використовувати як непрямий показник кількості колагену/колагенових пептидів. Повний аналіз амінокислот (включно з гідроксипроліном) кожної сировини був проведений Nofima Biolab; крім того, визначали вміст гідроксипроліну в акредитованій лабораторії (ALS, Норвегія) у водорозчинній фракції гідролізатів.



результати
Розподіл пептидів гідролізатів за розмірами – Загалом, для кожного перевіреного ферменту інкубація кожної сировини з вищою концентрацією ферменту та протягом більш тривалого періоду призвела до «вигідного» зсуву в профілі розміру пептидів гідролізатів (тобто збільшення частки менших пептидів ). Це показано на малюнку 2, де показано результати для кожної сировини з використанням «найкращого» ферменту при «неоптимальних» концентрації та тривалості порівняно з «оптимальною» концентрацією та тривалістю. З оптимізованими умовами ми виявили, що 100% пептидів мали ≤3 кДа, а більше 75% були <0.5 кДа (рис. 2).
На основі сукупних даних кількох досліджень на низці видів (наприклад, щури, свині, собаки, люди; див. (Zhangi & Matthews, 2010) для загального огляду, як правило, прийнято, що:
- Засвоєння пептидів краще в порівнянні з інтактним білком.
- Засвоєння пептидів краще, ніж вільних амінокислот.
- Поглинання малих пептидів краще, ніж великих пептидів.
Фізіологічно більшість амінокислот поглинається у вигляді малих пептидів, що складаються з 2 або 3 амінокислот, з’єднаних разом (ди- і трипептиди відповідно). Тому можна очікувати, що прийом білкового гідролізату, що містить високі пропорції ди- та трипептидів, сприятиме перетравленню та засвоєнню білка, що призведе до підвищення засвоюваності та біодоступності амінокислот. Середня молекулярна маса амінокислоти становить 110 Дальтон (Да), тому ди- та трипептиди матимуть молекулярну масу приблизно 220-330 Да (0.2-0.3 кДа). Наші результати в отриманні білкових гідролізатів із більш ніж 75% пептидів менше 0.5 кДа (тобто до ~ 5 амінокислот) означають, що білок у наших гранулах буде добре засвоюваним і легко засвоюватися домашніми тваринами, які їх їдять. Це планується продемонструвати за допомогою дослідження годівлі у співпраці з Факультетом ветеринарної медицини Гентського університету.
Крім того, досягнення 100% пептидів 3 кДа або менше знижує ризик виникнення алергічної реакції на джерела білка і тому може вважатися гіпоалергенним.
Малюнок 2.
Розподіл пептидів за розміром (кДа) у водній фазі гідролізатів кожної сировини, інкубованих з тим самим ферментом у «неоптимізованих» та «оптимізованих» умовах з точки зору концентрації ферменту та тривалості гідролізу. Зверніть увагу, зокрема, на те, як відсоток пептидів між 1.0-3.0 кДа зменшується, а пептидів <0.5 кДа збільшується, переходячи від «неоптимізованих» умов до «оптимізованих».

Вміст колагенового пептиду
Для кожної досліджуваної сировини ферменти A і C загалом показали «кращі» результати (з точки зору відновлення більшого відсотка гідроксипроліну у водній фазі гідролізатів), ніж фермент B при порівнянні заданої тривалості гідролізу та концентрації ферменту (наприклад, див. результати для лосося на малюнку 3).
Оскільки «неушкоджений» білок колагену не розчиняється у воді, присутність гідроксипроліну (наш маркер «колагену») у водній фазі вказує на те, що білок колагену був розщеплений у пептиди колагену (які є водорозчинними). Наші результати показують, що ми можемо використовувати ферментативний протеоліз для створення сировини, яка здатна приносити потенційні функціональні переваги, такі як підтримка здоров’я суглобів, здоров’я шкіри та здоров’я кишечника завдяки присутнім у них колагеновим пептидам.

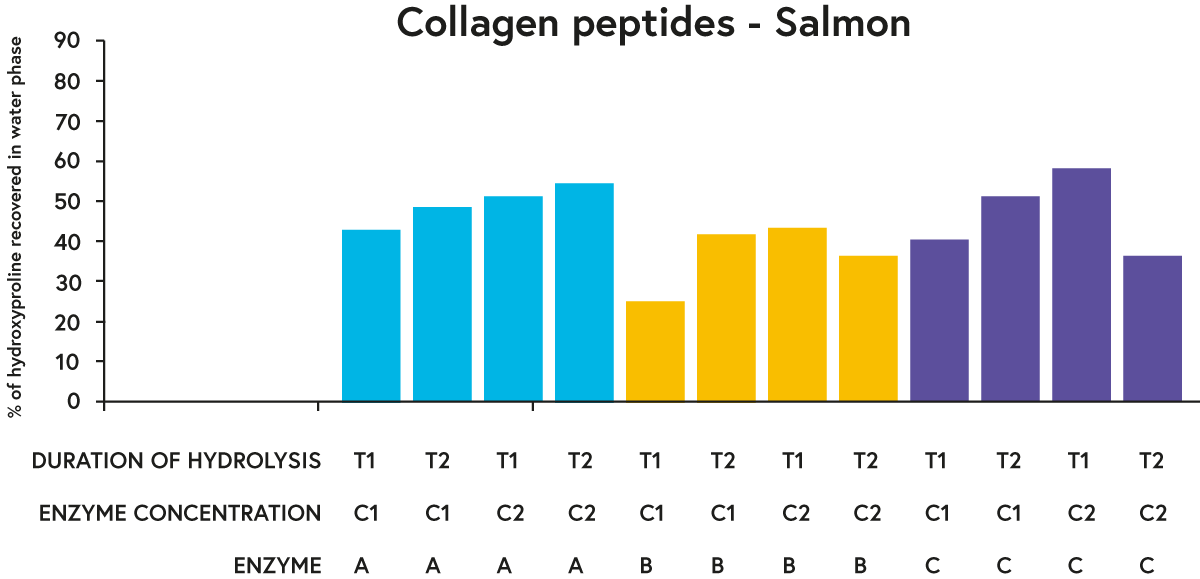
МАЛЮНОК 3. Відсоток гідроксипроліну (амінокислоти, яка міститься майже виключно в колагені), відновленого у водній фазі гідролізованого лосося за допомогою трьох різних ферментів (A, B або C), інкубованого з сировиною (лососем) у двох різних концентраціях (C1 або C2) для два різних періоди часу (T1 або T2).

Висновок
Ці позитивні результати дають можливість отримати додаткову користь від природної присутності колагену в певній сировині шляхом створення колагенових пептидів, які потенційно можуть забезпечити функціональні переваги, такі як підтримка здорових суглобів у активних домашніх тварин і покращення рухливості та гнучкості суглобів у літніх домашніх тварин, для приклад.
З високим відсотком (>75%) малих пептидів (<0.5 кДа), вироблених в «оптимізованих» умовах на основі цього дослідження, перша частина нашого HDP мета досягнута. Наступним важливим кроком є демонстрація того, що гранули, виготовлені з цим HDP, справді є більш засвоюваними та біодоступними, ніж наші існуючі свіжоприготовані продукти – ми зайняті цим у дослідженні годівлі з Гентський університет Ветеринарна школа. Слідкуйте за цим простором!



посилання
- Кейв, Н., 2006. Гідролізовані білкові дієти для собак і котів. Практика ветеринарних клінік для дрібних тварин, том 36, стор. 1251-1268.
- Dai, Z., Wu, Z., Jia, S. & Wu, G., 2014. Аналіз амінокислотного складу білків тваринних тканин і харчових продуктів як похідних о-фтальдіальдегіду перед колонкою за допомогою ВЕРХ з флуоресцентним детектуванням. J Хроматографія B, том 964, стор. 116-127.
- Daniel, H., 2004. Молекулярна та інтегративна фізіологія транспорту кишкових пептидів.. Annual Review of Physiology, том 66, стор. 361-384.
- Fei, Y. et al., 1994. Експресійне клонування транспортера олігопептидів, зв'язаного з протонами ссавців. Nature, том 7, стор. 563-566.
- Ханаока, К. та ін., 2019. Характеристика молекулярної маси білків і пептидів під час виробництва смакових добавок для кормів для домашніх тварин. [Онлайн] Доступно за адресою: https://www.diana-petfood.com/emea-en/publications/
- Hou, Y. et al., 2017. Білкові гідрозати в харчуванні тварин: промислове виробництво, біоактивні пептиди та функціональне значення. Журнал тваринництва та біотехнології, стор. 24-36.
- Knights, R., 1985. Переробка та оцінка білкових гідролізатів. В: Харчування для особливих потреб. Нью-Йорк: Марсель Деккер, стор. 105-115.
- MINTEL, 2017. Більша прозорість щодо білка в кормах для домашніх тварин, sl: MINTEL REPORTS.
- Pasupuleki, VK, Braun, S, 2010. Сучасне виробництво білкових гідролізатів. В кн.: Білкові гідролізати в біотехнології. Нью-Йорк: Springer, стор. 11-32.
- Zhangi, B. & Matthews, J., 2010. Фізіологічне значення та механізми поглинання білкового гідролізату. В кн.: Білкові гідролізати в біотехнології. Нью-Йорк: Springer, стор. 135-177.
