Dezvoltarea abordării hidrolizei proteinelor pentru a crește beneficiile nutriționale ale cărnii și peștelui proaspăt preparate.
O lucrare de susținere științifică a Dr. Adrian Hewson-Hughes | Consilier în nutriție, siguranță alimentară și inovare, GA Pet Food Partners.


Introducere.
Conținutul de proteine animale este bine stabilit ca fiind esența alimentelor de calitate premium pentru câini și pisici, iar mulți proprietari de animale de companie recunosc că aici se aplică zicala „calitate peste cantitate”. Potrivit companiei de cercetare de piață Mintel, 59% dintre proprietarii de pisici și 57% dintre proprietarii de câini spun că calitatea cărnii este mai importantă decât conținutul general de carne din hrana pentru animale de companie. (MINTEL, 2017).
GA Pet Food Partners a recunoscut de mult acest lucru. De la introducerea lui Freshtrusion®, GA a deschis calea în dezvoltarea și fabricarea dietelor care conțin cantități tot mai mari de surse de proteine din carne și pește proaspăt preparate. Beneficiile utilizării surselor de carne proaspătă și pește în comparație cu carnea și peștele uscate, topite, inclusiv un gust mai bun și o digestibilitate crescută, sunt bine apreciate atât de animalele de companie, cât și de proprietarii acestora.
Ne străduim să oferim partenerilor noștri produse și mai bune.
Piața hranei pentru animale de companie este foarte dinamică și, deși evidențierea proporției exacte ridicate de carne/pește/păsări în produse este o mișcare înțeleaptă, aceasta devine mai degrabă o așteptare de bază decât calitatea dorită pentru aceste produse de la proprietarii de animale de companie. Aici, la GA, ne străduim în mod constant să găsim modalități de a oferi partenerilor produse și mai bune și, de aceea, ne-am propus să facem ceea ce pare a fi imposibil - găsim o modalitate de a găti ingredientele noastre proaspete de carne și pește pentru a le face și mai bune pentru animalele de companie. .
Ideea este de a crește valoarea nutrițională a proteinei din ingredientele noastre proaspete din carne și pește, transformând proteinele în peptide mici, care sunt mai ușor absorbite de animalele de companie care le mănâncă (o numim „HDP” – Highly Digestible Protein). Pentru a ne ajuta în această căutare, am identificat experți de la Nofima, un institut de cercetare de top pentru cercetarea alimentară aplicată cu sediul în Norvegia, pentru a optimiza condițiile de digestie enzimatică a materiilor prime selectate din carne și pește și să le analizeze pentru a demonstra că am putea realiza ceea ce ne-am dorit. .



Digestia proteinelor – numită proteoliză sau hidroliză
Proteinele sunt molecule mari formate din „blocuri” individuale numite aminoacizi. După consumul de alimente care conțin proteine, procesul de proteoliză începe pe măsură ce enzimele eliberate în diferite părți ale tractului gastrointestinal îl descompun în aminoacizi și peptide mici. Acest lucru permite ca aceste blocuri să fie absorbite în organism, unde pot fi recombinate pentru a construi noi proteine (cum ar fi mușchi, piele, păr, anticorpi, enzime, hormoni etc.).
Este, de asemenea, posibil ca sursele de proteine să fie supuse unui proces controlat de proteoliză enzimatică, ca parte a pregătirii lor pentru includerea în alimentele fabricate și produsele nutriționale. De exemplu, hidrolizații de proteine au fost folosiți de zeci de ani în alimentația umană, în special în producerea de formule hipoalergenice de lapte pentru sugari pentru sugari/copii alergici la proteina din lapte de vacă.

Hidroliza enzimatică sau chimică
Hidroliza proteinelor – ruperea legăturilor peptidice care unesc aminoacizii prin adăugarea de apă – poate fi realizată prin diferite metode: chimic folosind acizi sau baze (alcaline) sau enzimatic (abordarea pe care ne concentrăm). În timp ce metodele de hidroliză acidă și alcalină a proteinelor oferă avantajul costului scăzut, există consecințe negative în ceea ce privește calitatea nutrițională a hidrolizatelor produse. Hidroliza acidă are ca rezultat distrugerea completă a aminoacidului esențial triptofan, precum și pierderea parțială a metioninei, cistinei și cisteinei. (Pasupuleki & Braun, 2010). În mod similar, hidroliza alcalină are ca rezultat distrugerea completă a majorității aminoacizilor, deși triptofanul poate supraviețui intact. (Dai, et al., 2014), (Hou, et al., 2017).
În comparație cu hidroliza acidă și alcalină, principalele avantaje ale hidrolizei enzimatice a proteinelor sunt:
- Condițiile de hidroliză, cum ar fi temperatura și pH-ul sunt ușoare și nu duc la pierderi cunoscute de aminoacizi.
- Utilizarea enzimei (enzimelor) protează este mai specifică și mai precisă în controlul extinderii hidrolizei și mărimii peptidelor.
- Cantitățile mici de enzimă utilizate pot fi ușor dezactivate (de exemplu, încălzire la 80 – 85ºC timp de cel puțin 3 minute) pentru a opri reacția de hidroliză. (Hou, et al., 2017).


Beneficiile nutriționale ale proteinelor hidrolizate enzimatic: digestibilitatea și absorbția proteinelor.
În plus față de metoda de hidroliză a proteinelor utilizată, așa cum sa subliniat anterior, valoarea nutrițională a hidrolizatelor proteice depinde de compoziția aminoacizilor liberi, a peptidelor mici (de obicei di- și tri-peptide) și a peptidelor mari prezente. Din punct de vedere istoric, s-a crezut că numai aminoacizii liberi au fost absorbiți din tractul gastrointestinal de către transportori specifici de aminoacizi. Acest lucru se întâmplă, dar acum este recunoscut că majoritatea aminoacizilor sunt absorbiți ca di- și tri-peptide de către transportorul peptidic cu specificitate largă PepT1. (Fei, et al., 1994). PepT1 poate transporta toate cele 400 de di-peptide și 8,000 de tri-peptide care rezultă din combinarea celor 20 de aminoacizi dieți diferiți (Daniel, 2004). Prin urmare, ar fi de așteptat ca ingestia unui hidrolizat proteic care conține proporții mari de di- și tri-peptide să faciliteze digestia și absorbția proteinelor, având ca rezultat digestibilitatea crescută și biodisponibilitatea aminoacizilor.
În mod clar, stabilirea celor mai bune condiții de enzimă și hidroliză este esențială pentru a putea crea hidrolizate de proteine cu profilurile dorite de dimensiunea peptidei finale. Distribuția mărimii peptidelor poate fi determinată folosind o tehnică numită cromatografia de excludere a mărimii. Cromatografia de excludere dimensională (SEC) este o tehnică de chimie analitică în care amestecurile de molecule (cum ar fi proteine sau peptide) dizolvate într-o soluție sunt separate după dimensiunea lor (așa cum este prezentat în figura 1).
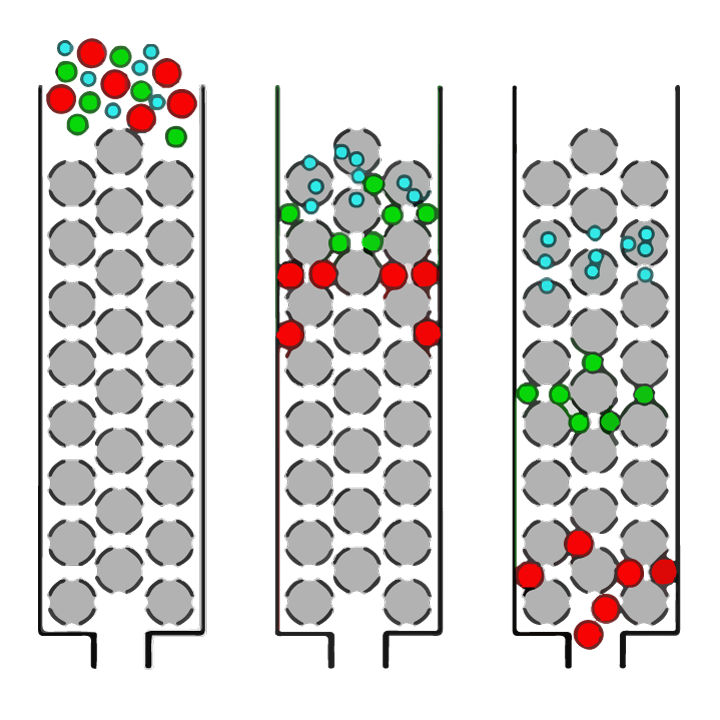
FIGURA 1. Privire de ansamblu simplă a separării moleculelor de diferite dimensiuni într-o soluție prin cromatografie de excludere a mărimii (SEC). Soluția este aplicată pe o coloană care este umplută cu o rășină de perle sferice poroase (sfere gri). Moleculele mari (cercuri roșii) nu vor putea pătrunde în porii (găurile) mărgelelor și, prin urmare, vor trece în coloană relativ repede și vor fi detectate mai întâi. Moleculele mai mici din eșantion pot pătrunde în pori în grade diferite, în funcție de dimensiunea lor. Moleculele „de dimensiuni medii” (cercuri verzi) vor putea intra în unele mărgele, dar nu în altele și, prin urmare, vor dura mai mult să treacă prin coloană, în timp ce cele mai mici molecule (cercurile albastre) vor putea intra în toți porii și vor lua cel mai lung să treacă prin coloană.
Metode
materii prime – Probe proaspete de carcasă de pui, carcasă de rață și rame de somon au fost reduse în dimensiune, omogenizate într-o pastă groasă și congelate. Ficatul proaspăt de miel a fost congelat întreg. Materialele au fost trimise către Nofima, Ås, Norvegia, pentru proteoliză și analiză.
Proteoliza – Pentru fiecare materie primă (pui, rață, somon și miel), o probă de 500 g a fost amestecată cu 990 ml apă distilată într-un vas de reacție de sticlă și agitată la 300 rpm. Pentru fiecare materie primă, trei enzime protează diferite au fost testate la două concentrații diferite și două momente de timp, rezultând 48 de probe de hidrolizat pentru analiză.
Cromatografia de excludere a mărimii – Distribuția greutății moleculare a fracției proteice solubile în apă a hidrolizatelor a fost determinată prin cromatografie de excludere dimensională utilizând un sistem de cromatografie lichidă de înaltă performanță (HPLC) Shimadzu LC-20AT cu un detector de fotodiode (SPD M20A) setat la 214 nm.
Conținutul de peptide de colagen – Hidroxiprolina este un aminoacid modificat, a cărui prezență se limitează în principal la colagen. Conținutul de hidroxiprolină din hidrolizatele proteice poate fi utilizat ca măsură indirectă a cantității de peptide de colagen/colagen prezente. O analiză completă a aminoacizilor (inclusiv hidroxiprolină) a fiecărei materii prime a fost efectuată de către Nofima Biolab; în plus, conținutul de hidroxiprolină a fost determinat la un laborator acreditat (ALS, Norvegia) în fracția solubilă în apă a hidrolizatelor.



REZULTATE
Distribuția mărimii peptidelor a hidrolizatelor – În general, pentru fiecare enzimă testată, incubarea fiecărei materii prime cu o concentrație mai mare de enzimă și pe o durată mai lungă a dus la o schimbare „benefică” a profilului de dimensiune a peptidei hidrolizate (adică o creștere a proporției de peptide mai mici). ). Acest lucru este evidențiat în Figura 2, care arată rezultatele pentru fiecare materie primă folosind cea mai bună enzimă la concentrația și durata „neoptimale” în comparație cu concentrația și durata „optime”. Cu condiții optimizate, am constatat că 100% dintre peptide au fost ≤3 kDa și mai mult de 75% au fost <0.5 kDa (Figura 2).
Pe baza dovezilor colective ale mai multor studii pe un număr de specii (de exemplu, șobolan, porc, câine, om; vezi (Zhangi și Matthews, 2010) pentru o prezentare generală, este în general bine acceptat că:
- Absorbția peptidelor este mai bună în comparație cu proteinele intacte.
- Absorbția peptidelor este mai bună decât aminoacizii liberi.
- Absorbția peptidelor mici este mai bună decât a peptidelor mari.
Din punct de vedere fiziologic, majoritatea aminoacizilor sunt absorbiți ca peptide mici formate din 2 sau 3 aminoacizi uniți împreună (di- și, respectiv, tri-peptide). Prin urmare, ar fi de așteptat ca ingestia unui hidrolizat proteic care conține proporții mari de di- și tri-peptide să faciliteze digestia și absorbția proteinelor, având ca rezultat digestibilitatea crescută și biodisponibilitatea aminoacizilor. Greutatea moleculară medie a unui aminoacid este de 110 Daltoni (Da), astfel încât di- și tri-peptidele ar avea o greutate moleculară de aproximativ 220-330 Da (0.2-0.3 kDa). Rezultatele noastre în obținerea de hidrolizate de proteine cu mai mult de 75% din peptide mai mici de 0.5 kDa (adică până la ~ 5 aminoacizi) înseamnă că proteina din crostele noastre ar fi foarte digerabilă și ușor absorbită de animalele de companie care le mănâncă. Este planificat să se demonstreze acest lucru printr-un studiu de hrănire în colaborare cu Facultatea de Medicină Veterinară, Universitatea din Gent.
În plus, obținerea a 100% din peptide de 3 kDa sau mai mici scade riscul declanșării unei reacții alergice la sursele de proteine și, prin urmare, poate fi considerată hipoalergenică.
Figura 2.
Distribuția mărimii (kDa) a peptidelor în faza apoasă a hidrolizatelor fiecărei materii prime incubate cu aceeași enzimă în condiții „neoptimizate” și „optimizate” în ceea ce privește concentrația enzimei și durata hidrolizei. Observați în special modul în care procentul de peptide între 1.0-3.0 kDa scade și peptidele <0.5 kDa crește, trecând de la condițiile „neoptimizate” la „optimizate”.

Conținutul de peptide de colagen
Pentru fiecare materie primă testată, enzimele A și C au avut rezultate „mai bune” în general (în ceea ce privește recuperarea unui procent mai mare de hidroxiprolină în faza apoasă a hidrolizatelor) decât enzima B când se compară o anumită durată de hidroliză și concentrația enzimei (de exemplu, vezi rezultate pentru somon din figura 3).
Deoarece proteina de colagen „intactă” nu este solubilă în apă, prezența hidroxiprolinei (markerul nostru de „colagen”) în faza apoasă indică faptul că proteina de colagen a fost digerată în peptide de colagen (care sunt solubile în apă). Rezultatele noastre ilustrează faptul că suntem capabili să folosim proteoliza enzimatică pentru a crea materii prime care sunt capabile să aducă beneficii funcționale potențiale, cum ar fi susținerea sănătății articulațiilor, a pielii și a sănătății intestinale prin peptidele de colagen prezente în ele.

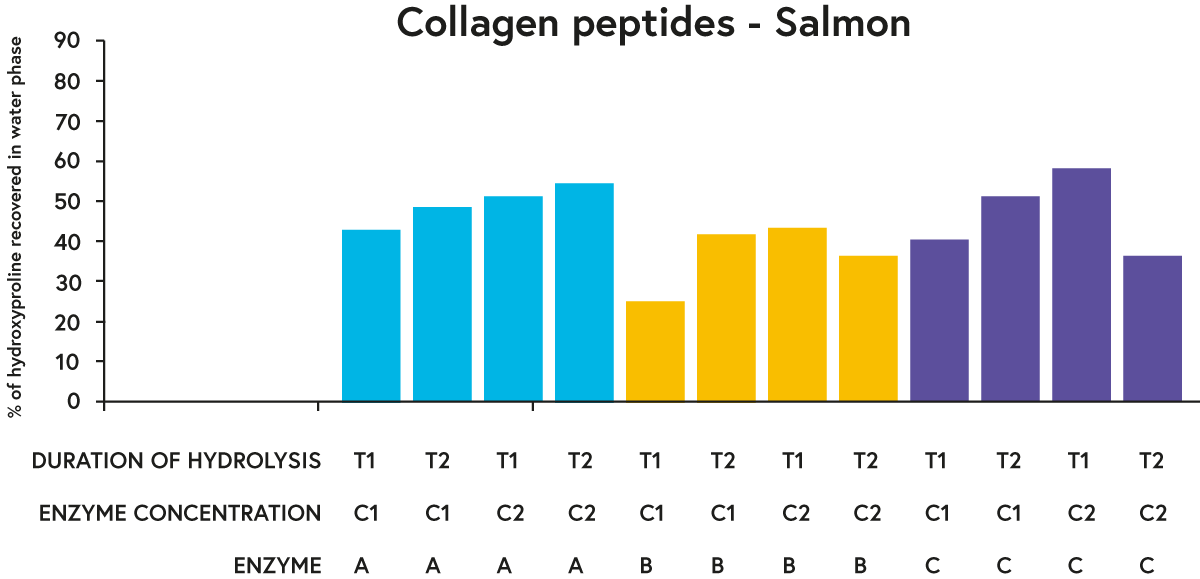
FIGURA 3. Procentul de hidroxiprolină (un aminoacid găsit aproape exclusiv în colagen) recuperat în faza apoasă a somonului hidrolizat cu trei enzime diferite (A, B sau C) incubate cu materia primă (somon) la două concentrații diferite (C1 sau C2) pt. două perioade de timp diferite (T1 sau T2).

Concluzie
Aceste rezultate pozitive prezintă oportunități de a câștiga valoare suplimentară din prezența naturală a colagenului în anumite materii prime, prin crearea de peptide de colagen cu potențialul de a oferi beneficii funcționale, cum ar fi menținerea articulațiilor sănătoase la animalele de companie active și îmbunătățirea mobilității și flexibilității articulațiilor la animalele mai în vârstă, pt. exemplu.
Cu procentul ridicat (>75%) de peptide mici (<0.5kDa) produse în condiții „optimizate” pe baza acestei cercetări, prima parte a noastră HDP scopul este atins. Următorul pas important este să demonstrăm că crochetele făcute cu acest HDP sunt într-adevăr mai digerabile și mai biodisponibile decât produsele noastre proaspăt preparate existente - suntem ocupați să realizăm acest lucru într-un studiu de hrănire cu Universitatea din Gent Scoala veterinara. Priveste acest spatiu!



Referinte
- Cave, N., 2006. Diete cu proteine hidrolizate pentru câini și pisici. Clinici veterinare Small Animal Practice, volumul 36, pp. 1251-1268.
- Dai, Z., Wu, Z., Jia, S. & Wu, G., 2014. Analiza compoziției de aminoacizi în proteinele țesuturilor animale și alimentelor ca derivați pre-coloană de o-ftaldialdehidă prin HPLC cu detectarea fluorescenței.. J Cromatografia B, Volumul 964, p. 116-127.
- Daniel, H., 2004. Molecular and integrative physiology of intestinal peptide transport.. Annual Review of Physiology, Volumul 66, pp. 361-384.
- Fei, Y. şi colab., 1994. Clonarea expresiei unui transportor de oligopeptide cuplate cu protoni de mamifer. Nature, Volumul 7, pp. 563-566.
- Hanaoka, K. și colab., 2019. Caracterizarea greutății moleculare a proteinelor și peptidelor în timpul producției de palatant pentru hrana pentru animale de companie. [Online] Disponibil la: https://www.diana-petfood.com/emea-en/publications/
- Hou, Y. et al., 2017. Hidroizati de proteine în nutriția animală: producție industrială, peptide bioactive și semnificație funcțională. Journal of Animal Science and Biotechnology, pp. 24-36.
- Knights, R., 1985. Procesarea și evaluarea hidrolizatelor de proteine. În: Nutriție pentru nevoi speciale. New York: Marcel Dekker, p. 105-115.
- MINTEL, 2017. Transparență mai mare în ceea ce privește proteinele din hrana pentru animale de companie, sl: RAPOARTE MINTEL.
- Pasupuleki, VK, Braun, S, 2010. Producția de ultimă generație a hidrolizatelor de proteine. În: Hidrolizate de proteine în biotehnologie. New York: Springer, pp. 11-32.
- Zhangi, B. & Matthews, J., 2010. Importanța fiziologică și mecanismele de absorbție a hidrolizatului de proteine. În: Hidrolizate de proteine în biotehnologie. New York: Springer, pp. 135-177.
