Olbaltumvielu hidrolīzes pieejas izstrāde, lai palielinātu svaigi pagatavotas gaļas un zivju uzturvērtības.
Dr Adrian Hewson-Hughes zinātniskais atbalsta dokuments | Uztura, pārtikas drošības un inovāciju padomnieks, GA Pet Food Partners.


Ievads.
Dzīvnieku olbaltumvielu saturs ir labi zināms kā augstākās kvalitātes suņu un kaķu barības būtība, un daudzi mājdzīvnieku īpašnieki atzīst, ka šeit ir spēkā sakāmvārds “kvalitāte pār kvantitāti”. Saskaņā ar tirgus pētījumu kompānijas Mintel datiem 59% kaķu un 57% suņu īpašnieku apgalvo, ka gaļas kvalitāte ir svarīgāka par kopējo gaļas saturu lolojumdzīvnieku barībā. (MINTEL, 2017).
GA Pet Food Partners to jau sen ir atzinis. Kopš ieviešanas Freshtrusion®, GA ir bijis līderis tādu diētu izstrādē un ražošanā, kas satur arvien lielāku daudzumu svaigi pagatavotu gaļas un zivju olbaltumvielu avotu. Svaigas gaļas un zivju avotu izmantošanas priekšrocības salīdzinājumā ar žāvētām, kausētām gaļas un zivju miltiem, tostarp labāku garšu un labāku sagremojamību, labi novērtē gan mājdzīvnieki, gan to īpašnieki.
Cenšamies piedāvāt saviem partneriem vēl labākus produktus.
Lolojumdzīvnieku barības tirgus ir ļoti dinamisks, un, lai gan īpaši augstā gaļas/zivju/mājputnu gaļas īpatsvara izcelšana produktos ir saprātīgs solis, tas kļūst par pamata cerību, nevis vēlamo šo produktu kvalitāti no mājdzīvnieku īpašniekiem. Mēs, GA, pastāvīgi cenšamies atrast veidus, kā piedāvāt partneriem vēl labākus produktus, un tāpēc mēs nolēmām paveikt šķietami neiespējamo — izdomāt veidu, kā pagatavot mūsu svaigās gaļas un zivju sastāvdaļas, lai tās būtu vēl labākas mājdzīvniekiem. .
Ideja ir palielināt mūsu svaigās gaļas un zivju sastāvdaļu proteīna uzturvērtību, pārvēršot olbaltumvielas mazos peptīdos, kurus mājdzīvnieki, kas to ēd, vieglāk uzsūc (mēs to saucam par “HDP” — ļoti sagremojamu proteīnu). Lai palīdzētu mums šajos meklējumos, mēs noskaidrojām ekspertus no Nofima, vadošā lietišķās pārtikas pētniecības institūta Norvēģijā, lai optimizētu apstākļus atlasīto gaļas un zivju izejvielu fermentatīvai sagremošanai un analizētu tos, lai parādītu, ka varam sasniegt to, ko vēlējāmies. .



Olbaltumvielu sagremošana - arī proteolīze vai hidrolīze
Olbaltumvielas ir lielas molekulas, kas sastāv no atsevišķiem “celtniecības blokiem”, ko sauc par aminoskābēm. Pēc olbaltumvielas saturošas pārtikas ēšanas sākas proteolīzes process, jo fermenti, kas izdalās dažādās kuņģa-zarnu trakta daļās, sadala to aminoskābēs un mazos peptīdos. Tas ļauj šiem celtniecības blokiem uzsūkties organismā, kur tos var rekombinēt, veidojot jaunas olbaltumvielas (piemēram, muskuļus, ādu, matus, antivielas, fermentus, hormonus utt.).
Ir arī iespējams, ka olbaltumvielu avoti tiek pakļauti kontrolētam enzīmu proteolīzes procesam, kas ir daļa no to sagatavošanas iekļaušanai ražotajos pārtikas produktos un uztura produktos. Piemēram, olbaltumvielu hidrolizāti cilvēku uzturā ir izmantoti gadu desmitiem, jo īpaši hipoalerģisku piena maisījumu ražošanā zīdaiņiem/bērniem, kuriem ir alerģija pret govs piena olbaltumvielām.

Enzīmu vai ķīmiskā hidrolīze
Olbaltumvielu hidrolīzi – peptīdu saišu pārraušanu, kas savieno aminoskābes kopā, pievienojot ūdeni – var panākt ar dažādām metodēm: ķīmiski izmantojot skābes vai bāzes (sārmu) vai fermentatīvi (pieeja, uz kuru mēs koncentrējamies). Lai gan proteīnu skābās un sārmainās hidrolīzes metodes piedāvā zemu izmaksu priekšrocības, tām ir negatīvas sekas ražoto hidrolizātu uzturvērtības ziņā. Skābes hidrolīzes rezultātā tiek pilnībā iznīcināta neaizvietojamās aminoskābes triptofāns, kā arī daļēja metionīna, cistīna un cisteīna zudums. (Pasupuleki & Braun, 2010). Līdzīgi sārmainās hidrolīzes rezultātā lielākā daļa aminoskābju tiek pilnībā iznīcinātas, lai gan triptofāns var izdzīvot neskarts (Dai, un citi., 2014), (Čau, un citi., 2017).
Salīdzinot ar skābju un sārmainu hidrolīzi, proteīnu fermentatīvās hidrolīzes galvenās priekšrocības ir:
- Hidrolīzes apstākļi, piemēram, temperatūra un pH, ir viegli un neizraisa zināmus aminoskābju zudumus.
- Proteāzes enzīma(-u) izmantošana ir specifiskāka un precīzāka, kontrolējot hidrolīzes apjomu un peptīdu izmēru.
- Nelielus izmantotā fermenta daudzumus var viegli deaktivizēt (piemēram, karsējot līdz 80–85ºC vismaz 3 minūtes), lai apturētu hidrolīzes reakciju. (Čau, un citi., 2017).


Enzīmi hidrolizēta proteīna uzturvērtības: olbaltumvielu sagremojamība un uzsūkšanās.
Papildus izmantotajai proteīnu hidrolīzes metodei, kā aprakstīts iepriekš, olbaltumvielu hidrolizātu uzturvērtība ir atkarīga no brīvo aminoskābju, mazu peptīdu (parasti di- un tripeptīdu) un lielo peptīdu sastāva. Vēsturiski tika uzskatīts, ka specifiski aminoskābju transportētāji no kuņģa-zarnu trakta uzsūcas tikai brīvās aminoskābes. Tas notiek, bet tagad ir atzīts, ka lielākā daļa aminoskābju tiek absorbētas kā di- un tripeptīdus plašas specifikas peptīdu transportētājā PepT1. (Fei, un citi., 1994). PepT1 potenciāli var transportēt visus 400 dipeptīdus un 8,000 tripeptīdus, kas rodas, apvienojot 20 dažādas uztura aminoskābes (Daniels, 2004). Tāpēc ir sagaidāms, ka proteīna hidrolizāta, kas satur lielu daudzumu di- un tripeptīdu, uzņemšana atvieglotu olbaltumvielu sagremošanu un uzsūkšanos, kā rezultātā palielināsies sagremojamība un aminoskābju biopieejamība.
Skaidrs, ka vislabāko enzīmu un hidrolīzes apstākļu noteikšana ir ļoti svarīga, lai varētu izveidot proteīna hidrolizātus ar vēlamajiem gala peptīdu izmēra profiliem. Peptīdu izmēru sadalījumu var noteikt, izmantojot metodi, ko sauc par izmēru izslēgšanas hromatogrāfiju. Izmēru izslēgšanas hromatogrāfija (SEC) ir analītiskās ķīmijas paņēmiens, kurā šķīdumā izšķīdinātu molekulu (piemēram, proteīnu vai peptīdu) maisījumus atdala pēc to lieluma (kā parādīts 1. attēlā).
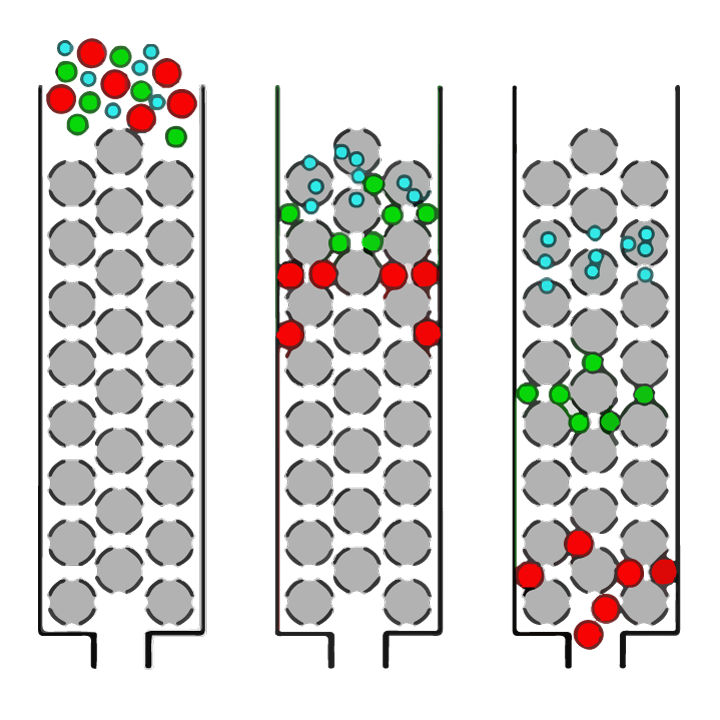
1 attēls. Vienkāršs pārskats par dažāda izmēra molekulu atdalīšanu šķīdumā ar izmēru izslēgšanas hromatogrāfiju (SEC). Šķīdumu uzklāj uz kolonnas, kas pildīta ar porainu sfērisku lodīšu (pelēku lodīšu) sveķiem. Lielas molekulas (sarkani apļi) nespēs iekļūt lodīšu porās (caurumos), tāpēc salīdzinoši ātri iziet pa kolonnu un tiks atklātas pirmās. Mazākas molekulas paraugā var iekļūt porās dažādās pakāpēs atkarībā no to lieluma. “Vidēja izmēra” molekulas (zaļi apļi) varēs iekļūt dažās lodītes, bet ne citās, tāpēc tām būs nepieciešams ilgāks laiks, lai tās izietu cauri kolonnai, savukārt mazākās molekulas (zili apļi) varēs iekļūt visās porās un aizņems visilgāk iziet cauri kolonnai.
Metodes
izejvielas – Svaigi vistas liemeņa, pīles liemeņa un laša rāmju paraugi tika samazināti, homogenizēti biezā pastā un sasaldēti. Svaigas jēra aknas tika sasaldētas veselas. Materiāli tika nosūtīti uz Nofima, Ås, Norvēģija, proteolīzei un analīzei.
Proteolīze – Katrai izejvielai (vistai, pīlei, lasim un jēram) 500 g paraugs tika sajaukts ar 990 ml destilēta ūdens stikla reakcijas traukā un maisīts ar ātrumu 300 apgr./min. Katrai izejvielai tika pārbaudīti trīs dažādi proteāzes enzīmi divās dažādās koncentrācijās un divos laika punktos, kā rezultātā analīzei tika iegūti 48 hidrolizāta paraugi.
Izmēru izslēgšanas hromatogrāfija – Hidrolizātu ūdenī šķīstošo proteīnu frakcijas molekulmasas sadalījums tika noteikts ar izmēru izslēgšanas hromatogrāfiju, izmantojot Shimadzu LC-20AT augstas izšķirtspējas šķidruma hromatogrāfijas (HPLC) sistēmu ar fotodiodes matricas detektoru (SPD M20A), kas iestatīts uz 214 nm.
Kolagēna peptīdu saturs – Hidroksiprolīns ir modificēta aminoskābe, kuras klātbūtne galvenokārt ir saistīta ar kolagēnu. Hidroksiprolīna saturu olbaltumvielu hidrolizātos var izmantot kā netiešu kolagēna/kolagēna peptīdu daudzuma mērījumu. Nofima Biolab veica katras izejvielas pilnu aminoskābju analīzi (ieskaitot hidroksiprolīnu); turklāt hidroksiprolīna saturs tika noteikts akreditētā laboratorijā (ALS, Norvēģija) hidrolizātu ūdenī šķīstošajā frakcijā.



rezultāti
Hidrolizātu peptīdu lieluma sadalījums – Kopumā katram pārbaudītajam enzīmam katras izejvielas inkubācija ar augstāku fermenta koncentrāciju un ilgāku laiku izraisīja “labvēlīgas” izmaiņas hidrolizātu peptīdu izmēra profilā (ti, palielinājās mazāku peptīdu īpatsvars). ). Tas ir izcelts 2. attēlā, kurā parādīti rezultāti katrai izejvielai, izmantojot “labāko” fermentu “neoptimālā” koncentrācijā un ilgumā, salīdzinot ar “optimālo” koncentrāciju un ilgumu. Optimizētos apstākļos mēs atklājām, ka 100% peptīdu bija ≤3 kDa un vairāk nekā 75% bija <0.5 kDa (2. attēls).
Pamatojoties uz kolektīviem pierādījumiem vairākos pētījumos ar vairākām sugām (piemēram, žurkām, cūkām, suņiem, cilvēkiem; sk (Zhangi & Matthews, 2010) lai sniegtu pārskatu, ir vispāratzīts, ka:
- Peptīdu uzsūkšanās ir labāka salīdzinājumā ar neskartu proteīnu.
- Peptīdu uzsūkšanās ir labāka nekā brīvās aminoskābes.
- Mazo peptīdu uzsūkšanās ir labāka nekā lielo peptīdu absorbcija.
Fizioloģiski lielākā daļa aminoskābju tiek absorbētas kā mazi peptīdi, kas sastāv no 2 vai 3 aminoskābēm, kas savienotas kopā (attiecīgi di- un tripeptīdi). Tāpēc ir sagaidāms, ka proteīna hidrolizāta, kas satur lielu daudzumu di- un tripeptīdu, uzņemšana atvieglotu olbaltumvielu sagremošanu un uzsūkšanos, kā rezultātā palielināsies sagremojamība un aminoskābju biopieejamība. Aminoskābes vidējā molekulmasa ir 110 daltoni (Da), tāpēc di- un tripeptīdu molekulmasa būtu aptuveni 220–330 Da (0.2–0.3 kDa). Mūsu rezultāti, iegūstot olbaltumvielu hidrolizātus ar vairāk nekā 75% peptīdu, kas ir mazāki par 0.5 kDa (ti, līdz ~ 5 aminoskābēm), nozīmē, ka olbaltumvielas mūsu drupās būtu labi sagremojamas un viegli absorbējamas mājdzīvniekiem, kas tos ēd. To plānots demonstrēt, veicot barošanas pētījumu sadarbībā ar Gentes Universitātes Veterinārmedicīnas fakultāti.
Turklāt, sasniedzot 100% peptīdu, kuru svars ir 3 kDa vai mazāks, samazinās risks izraisīt alerģisku reakciju pret olbaltumvielu avotiem, un tāpēc to var uzskatīt par hipoalerģisku.
Skaitlis 2.
Peptīdu lieluma sadalījums (kDa) katras izejvielas hidrolizātu ūdens fāzē, kas inkubēts ar vienu un to pašu fermentu “neoptimizētos” un “optimizētos” apstākļos fermentu koncentrācijas un hidrolīzes ilguma ziņā. Īpaši ņemiet vērā, kā samazinās peptīdu procentuālais daudzums starp 1.0–3.0 kDa un palielinās peptīdu skaits, kas mazāki par 0.5 kDa, pārejot no “neoptimizētiem” uz “optimizētiem” apstākļiem.

Kolagēna peptīdu saturs
Salīdzinot noteiktu hidrolīzes ilgumu un fermentu koncentrāciju, attiecībā uz katru pārbaudīto izejvielu enzīmi A un C kopumā darbojās “labāk” (attiecībā uz lielāku hidroksiprolīna procentuālās daļas atgūšanu hidrolizātu ūdens fāzē) nekā enzīms B. rezultāti lasim 3. attēlā).
Tā kā “neskarts” kolagēna proteīns nešķīst ūdenī, hidroksiprolīna (mūsu “kolagēna” marķiera) klātbūtne ūdens fāzē norāda, ka kolagēna proteīns ir sagremots kolagēna peptīdos (kas šķīst ūdenī). Mūsu rezultāti parāda, ka mēs varam izmantot fermentatīvo proteolīzi, lai radītu izejvielas, kas spēj sniegt potenciālus funkcionālus ieguvumus, piemēram, atbalstīt locītavu veselību, ādas veselību un zarnu veselību, izmantojot tajās esošos kolagēna peptīdus.

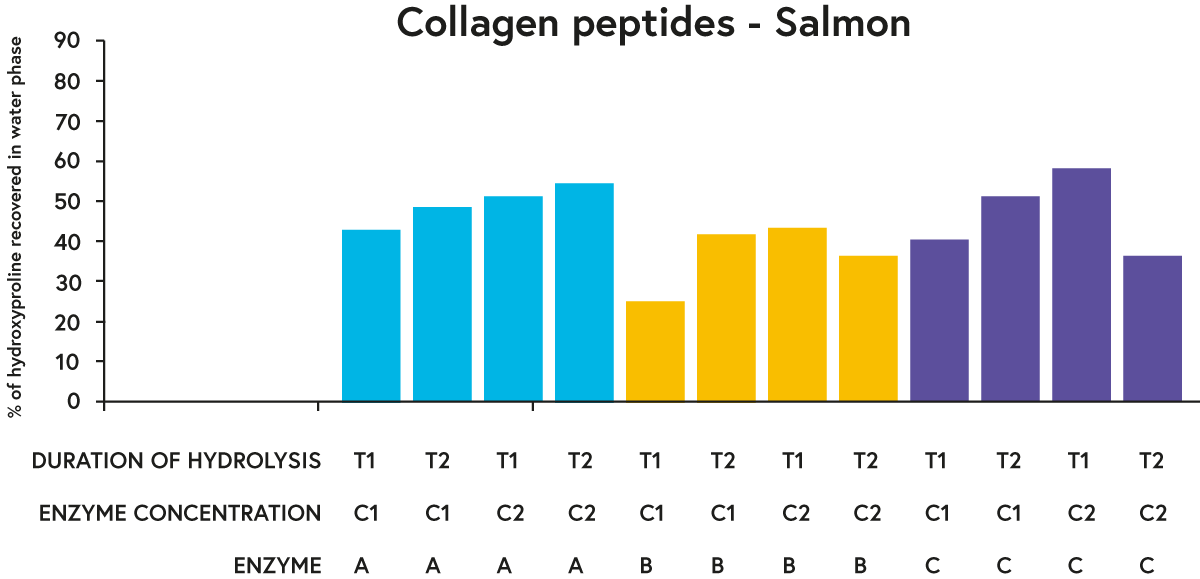
ATTĒLS 3. Hidroksiprolīna (aminoskābe, kas atrodama gandrīz tikai kolagēnā) procentuālā daļa, kas atgūta hidrolizēta laša ūdens fāzē ar trim dažādiem fermentiem (A, B vai C), kas inkubēti ar izejvielu (lasi) divās dažādās koncentrācijās (C1 vai C2) divi dažādi laika periodi (T1 vai T2).

Secinājumi
Šie pozitīvie rezultāti sniedz iespēju iegūt papildu vērtību no dabiskās kolagēna klātbūtnes noteiktās izejvielās, radot kolagēna peptīdus, kas var sniegt funkcionālus ieguvumus, piemēram, uzturēt veselas locītavas aktīviem mājdzīvniekiem un uzlabot locītavu mobilitāti un elastību vecākiem mājdzīvniekiem. piemērs.
Ņemot vērā lielo procentuālo daļu (>75%) mazu peptīdu (<0.5 kDa), kas ražoti “optimizētos” apstākļos, pamatojoties uz šo pētījumu, mūsu pētījuma pirmā daļa. HDP mērķis ir sasniegts. Nākamais svarīgais solis ir pierādīt, ka ar šo HDP izgatavotie grauzdiņi patiešām ir labāk sagremojami un bioloģiski pieejami nekā mūsu esošie svaigi pagatavotie produkti — mēs esam aizņemti, veicot to barošanas pētījumā ar Gentas Universitāte Veterinārārskola. Skatieties šo vietu!



Atsauces
- Cave, N., 2006. Hidrolizētu proteīnu diētas suņiem un kaķiem. Veterinārās klīnikas mazo dzīvnieku prakse, 36. sējums, 1251.-1268.lpp.
- Dai, Z., Wu, Z., Jia, S. & Wu, G., 2014. Aminoskābju sastāva analīze dzīvnieku audu proteīnos un pārtikas produktos kā pirmskolonnas o-ftaldialdehīda atvasinājumi ar HPLC ar fluorescences noteikšanu. Hromatogrāfija B, 964. sējums, 116.-127. lpp.
- Daniel, H., 2004. Molecular and integrative physiology of intestinal peptide transport.. Annual Review of Physiology, Volume 66, pp. 361-384.
- Fei, Y. et al., 1994. Expression cloning of a mammalian proton-coupled oligopeptide transporter. Nature, Volume 7, pp. 563-566.
- Hanaoka, K. et al., 2019. Olbaltumvielu un peptīdu molekulmasas raksturojums lolojumdzīvnieku barības garšvielu ražošanas laikā. [Tiešsaiste] Pieejams: https://www.diana-petfood.com/emea-en/publications/
- Hou, Y. et al., 2017. Olbaltumvielu hidroizāti dzīvnieku ēdināšanā: rūpnieciskā ražošana, bioaktīvie peptīdi un funkcionālā nozīme. Journal of Animal Science and Biotechnology, 24.-36.lpp.
- Knights, R., 1985. Olbaltumvielu hidrolizātu apstrāde un novērtēšana. In: Uzturs īpašām vajadzībām. Ņujorka: Marsels Dekers, 105.–115. lpp.
- MINTEL, 2017. Lielāka pārskatāmība attiecībā uz proteīnu lolojumdzīvnieku barībā, sl: MINTEL REPORTS.
- Pasupuleki, VK, Braun, S, 2010. Proteīna hidrolizātu ražošana. In: Protein Hydrolysates in Biotechnology. Ņujorka: Springer, 11.–32. lpp.
- Zhangi, B. & Matthews, J., 2010. Olbaltumvielu hidrolizāta uzsūkšanās fizioloģiskā nozīme un mehānismi. In: Protein Hydrolysates in Biotechnology. New York: Springer, 135.–177. lpp.
